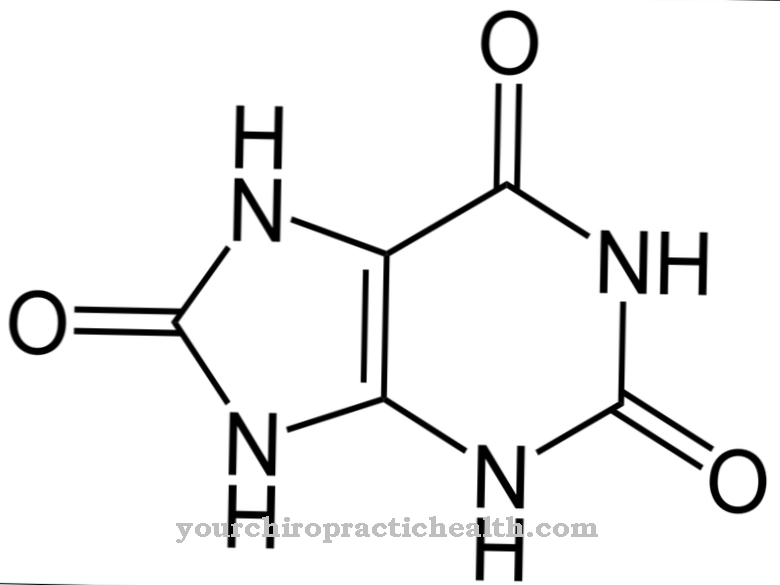
fluoras žymi cheminį elementą, kurio atominis skaičius 9, ir priklauso halogenams. Tai stipriai ėsdinančios dujos, kurios smarkiai pažeidžia gleivines. Fluoras yra naudojamas mediciniškai kaip jo druskos, fluoras, dantims stiprinti.
Kas yra fluoras?
Fluoras yra labai kaustinės ir reaguojančios dujos. Tai nėra junginys, o cheminis elementas, priklausantis halogenams. Su atominiu numeriu 9 jis yra lengviausias halogenas. Gamtoje fluoras daugiausia susidaro kaip jo druskos, fluoridai.
Dujų fluoras nėra labai stabilus ir reaguoja su beveik visais junginiais ir elementais iškart po jo pagaminimo. Tik naudojant tauriųjų dujų helį ir neoną nevyksta jokios reakcijos. Šis ypač stiprus reaktyvumas gali būti paaiškinamas labai stipriu afinitetu elektronams. Jis visada pašalina elektronus iš savo reakcijos partnerių ir todėl yra stipriausias oksidatorius. Pavadinimas fluoras kildinamas iš lotynų kalbos „fluores“ (upė). Kaip kalcio fluoridas (fluoro špagas) jis naudojamas kaip rūdų srautas.
Kai į rūdas pridedama fluoras, sumažėja jų lydymosi temperatūra, kad jos greičiau pasidarytų skystos. Konceptualiu požiūriu medicinoje yra terminas „fluoro lytiniai organai“, skirtas sekrecijai be kraujo šalinti iš moters lytinių organų. Tačiau lytinių organų fluoras neturi būti painiojamas su fluoro elementu.
Funkcija, poveikis ir užduotys
Fluoras yra vadinamas esminiu mikroelementu. Tačiau fluoro svarba yra ginčytina. Yra žinoma, kad fluoridai turi apsaugines savybes nuo dantų. Fluoras gali sustiprinti dantis ir tuo pat metu slopinti tam tikrus ėduonies bakterijų fermentus, kurie sukelia angliavandenių skaidymąsi.
Fluorai veikia tiesiai ant danties. Geriamasis fluoridas neturi įtakos dantims. Dantus daugiausia sudaro mineralinis hidroksiapatitas. Hidroksiapatitą gali užpulti rūgštys, kurios susidaro suskaidžius maisto likučius. Dėl prastos dantų higienos dantyse dažnai atsiranda skylių, kurias vis dar užima karieso bakterijos. Pvz., Jei dantų pastoje yra fluoro, hidroksilo jonai keičiasi fluoro jonais. Dėl to susidaro fluorapatitas, kuris yra kietesnė medžiaga ir mažiau jautrus rūgštims. Net rūgščių ištirpintas hidroksiapatitas gali būti vėl nusodinamas kaip fluoroapatitas, esant fluorams.
Taigi pradinį sunaikinimą galima pakeisti. Tačiau fluoridai taip pat turi teigiamų savybių kaulų formavimui. Čia suvartojimas vyksta žodžiu. Vaikams ir kūdikiams skiriama fluoro ir vitamino D, kad būtų išvengta rachito. Tačiau fluoro negalima perdozuoti, kad negalėtų išsivystyti fluorozė kartu su sąnarių sustingimu ir sustorėjimu. Fluoro junginiai taip pat patvirtinami kaip vaistai nuo osteoporozės. Atitinkamose tabletėse yra natrio fluorido arba dinatrio fluorofosfato.
Išsilavinimas, atsiradimas, savybės ir optimalios vertės
Fluoras yra juodosios ir žaliosios arbatos, šparagų ir žuvies fluoridų pavidalu. Daugelyje druskų yra fluoro. Dėl mažo fluoro turinčių junginių tirpumo vandenyje nėra grynų fluoro druskų. Fluorpadas (kalcio fluoras) ir fluorapatitas yra labiausiai paplitę žemės plutoje.
Fluoras daugiausia gaminamas iš kalcio fluorido. Yra netgi organizmų, galinčių sudaryti organinius fluoro junginius. Pietų Afrikos Gifblaar arba Dichapetalum genties augalai gali sintetinti fluoro acto rūgštį nuo plėšrūnų. Žmogaus organizmui paros poreikis yra 0,25–0,35 mg.
Ligos ir sutrikimai
Tačiau dažnesni apsinuodijimai fluoru ir sveikatos problemos. Kaip minėta anksčiau, grynas fluoras yra labai nuodingos ėsdinančios dujos. Tai taip pat apsunkina fluoro gaminimą.
Kadangi jis reaguoja su beveik visomis medžiagomis, jį taip pat galima laikyti ir transportuoti labai prastai. Apsinuodijus fluoru, cheminiai nudegimai ir nudegimai atsiranda plaučiuose, odoje ir akyse. Atsižvelgiant į dozę, atitinkami organai ištirpsta per trumpą laiką ir gali mirti. Mirtina dozė yra labai maža ir yra 185 ppm. Apsinuodijimas grynu fluoru retai pasitaiko, nes dujos nėra stabilios. Tačiau vandenilio fluorido apsinuodijimas yra panašiai pavojingas. Vandenilio fluoridas sudaro vandenilio ryšius su baltymais kūne, tuo būdu sunaikinama tretinė baltymų struktūra. Vyksta kūno baltymų denatūracija.
Fluorai gali sudaryti sudėtinius junginius su aliuminio jonais, kurie turi panašų poveikį kaip fosfatai. Šie organizmai įsitraukia į fosforilinimo reakcijas. Be kitų dalykų, tai lemia G baltymų reguliavimo panaikinimą, dėl kurio slopinama daugybė fermentų. Vien dėl šios priežasties organizmas netoleruoja padidintos fluoro dozės. Išgėrus per daug fluoro tablečių, gali atsirasti pykinimas, vėmimas ir viduriavimas. Fluoras reaguoja su skrandžio rūgštimi, susidarant nedideliam vandenilio fluorido rūgšties kiekiui. Tai užpuola gleivinę. Lėtinis, lengvas fluoro perdozavimas gali sukelti fluorozę.
Fluorozė yra lėtinis apsinuodijimas fluoru kartu su danties emalio struktūros pokyčiais, kosuliu, skrepliais ir dusuliu. Per daug hidroksiapatito dantyse virsta fluoroapatitu. Dantys tampa trapesni. Kaulai taip pat keičiasi dėl per didelio fluorapatito susidarymo. Kaulai lėtai sustingsta ir atsinaujina. Be to, fermento enolazė yra slopinama.


.jpg)







.jpg)