Enteropeptidazė yra dvylikapirštės žarnos gleivinės fermentas, kurio funkcija yra suaktyvinti kasos fermentus. Jis yra visos virškinimo fermentų aktyvavimo kaskados pradžioje. Dėl enteropeptidazės funkcijos sutrikimo maisto virškinimas ir malabsorbcija vyksta plonojoje žarnoje.
Kas yra enteropeptidazė?
Enteropeptidazė yra dvylikapirštės žarnos gleivinės fermentas, suaktyvinantis kasos virškinimo fermentus, aktyvindamas tripsiną į tripsiną.
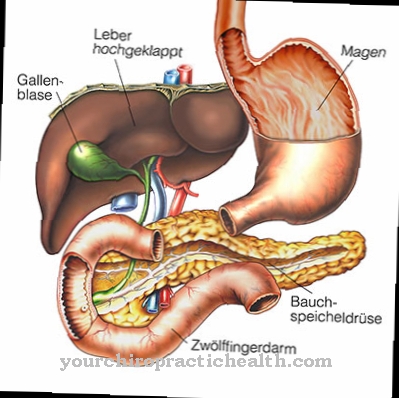
Enteropeptidazė sekretuojama dvylikapirštės žarnos gleivinės šepečio krašte. Tiksliau, sekrecija yra liebekühn liaukos. Liebekühn liaukos yra vamzdinės depresijos mažojo ir storojo žarnos epitelyje. Plonojoje žarnoje jie yra tarp plonosios žarnos viržių. Liaukos, dar žinomos kaip Lieberkühn kriptos, be enteropeptidazės išskiria daugybę fermentų. Enteropeptidazės sekrecija stimuliuojama, kai skrandyje iš anksto suvirškintas chymas patenka į dvylikapirštę žarną. Vien fermentas nedaro įtakos maisto komponentams.
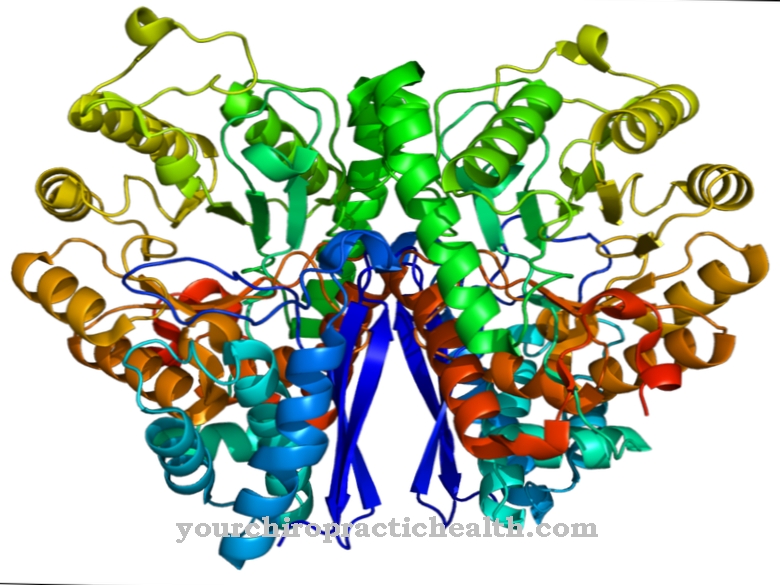
Tik fermento tripsino aktyvinimas nustato visą judančių virškinimo fermentų aktyvavimo kaskadą. Enteropeptidazė, kaip ir tripsinas bei kitos kasos proteazės, yra serino proteazė. Aktyviame centre yra asparto rūgšties, histidino ir serino katalizinė triada. Kaip endopeptidazė, enteropeptidazė skaldo baltymus tik tam tikruose būdinguose taškuose su tam tikrais atpažinimo motyvais amino rūgščių seka. Fermentas visada suskaidomas pagal Asp-Asp-Asp-Asp-Lys atpažinimo motyvą. Naudojant tripsinogeną, heksapeptidas Val- (Asp) 4-Lys suskaidomas, susidarant tripsinui.
Funkcija, poveikis ir užduotys
Enteropeptidazės funkcija yra suaktyvinti virškinimo fermentus kasoje. Jis tik pradeda pirmąjį aktyvavimo žingsnį, pakeisdamas tripsinogeną į tripsiną.
Savo ruožtu tripsinas yra serino proteazė, skaldanti baltymus pagal tą patį būdingą atpažinimo motyvą. Dabar tęsiamas paties tripsinogeno aktyvinimas. Tuo pačiu metu jis aktyvuoja kitus kasos fermentus iš jų pirmtakų, tokių kaip chimotripsinogenas, proelastazė, prokarboksipeptidazė, profosfolipazė ir proenteropeptidazė. Enteropeptidazė iš pradžių taip pat yra neaktyvi. Kai chyme patenka į dvylikapirštę žarną, išsiskiria ne tik proenteropeptidazė, bet ir duodenazė, kuri suaktyvina enteropeptidazės formavimąsi. Pradėjus aktyvavimo kaskadą, tripsinas perima visų kasos fermentų, įskaitant proenteropeptidazę ir tripsinogeną, aktyvaciją.
Proenteropeptidazės aktyvacija į enteropeptidazę vyksta dar veiksmingiau, veikiant tripsinui, nei per dvylikapirštę žarną. Nepaprastai svarbus virškinimo fermentų buvimas neaktyvia forma. Proteazių veikimas yra konkretus. Visi baltymai, turintys būdingą atpažinimo motyvą molekulėje, yra hidrolizuojami. Jei fermentai būtų katalitiškai aktyvūs iškart, paties kūno baltymai jau būtų suvirškinami kasoje ir kasos latake. Dėl to kasa ištirptų. Aktyvinimas vyksta tik dvylikapirštėje žarnoje, esančioje už egzokrininių liaukų.
Fermentai gali pradėti skaidyti maisto komponentus, nepažeisdami paties organizmo audinių. Siekiant užkirsti kelią fermentų aktyvavimui per anksti, kasos latake veikia papildomas tripsino inhibitorius. Tačiau pagrindinį vaidmenį virškinimo kaskadoje vaidina tripsinas. Įjungus šį fermentą, visų virškinimo fermentų, įskaitant enteropeptidazę, aktyvavimo negalima sustabdyti.
Išsilavinimas, atsiradimas, savybės ir optimalios vertės
Enteropeptidazė, kaip ir visos serino proteazės, taip pat turi nespecifinį poveikį ir skaido baltymus naudodama būdingą atpažinimo motyvą. Enteropeptidazę sudaro lengvoji ir sunkioji grandinės, sujungtos disulfidiniais tiltais. Serino proteazės domenas yra lengvojoje grandinėje.
Sunkiosios grandinės molekulinė masė yra nuo 82 iki 140 kilodaltonų, o lengvosios grandinės molekulinė masė yra nuo 35 iki 62 kilodaltonų. Enteropeptidazės lengvosios grandinės struktūra yra panaši į kitų serino proteazių tripsino ir chimotripsino. Sunkioji grandinė yra sujungta su membrana ir daro įtaką fermento specifiškumui. Buvo nustatyta, kad izoliuota lengvoji grandinė turi panašų poveikį būdingam atpažinimo motyvui - (Asp) 4-Lys-, tačiau žymiai mažesnį poveikį tripsinogenui.
Ligos ir sutrikimai
Žmogaus enteropeptidazę koduoja ENTK genas 21 chromosomoje. Dėl šio geno mutacijos paveikti vaikai gali sukelti rimtų ligų.
Fermentas nebegali aktyvinti kitų virškinimo fermentų. Maisto komponentai nebeskaidomi, todėl jų nebeįmanoma absorbuoti plonojoje žarnoje. Pirmiausia tai yra netinkamas virškinimas (nepakankamas skilimas), dėl kurio maisto komponentai absorbuojasi. Kūnas nebėra tinkamai aprūpinamas maistinėmis medžiagomis. Atsiranda klestėjimas, sulėtėjęs augimas ir tipiški baltymų trūkumo simptomai, atsirandantys edema. Tuo pačiu metu, be baltymų, angliavandeniai ir riebalai yra blogai absorbuojami. Nesuvirškinti maisto komponentai patenka į storąją žarną ir ten suskaidomi fermentuojant bei sukeliant putrefektyvias bakterijas, taip pat atsiranda vidurių pūtimas, viduriavimas ir pilvo skausmas.
Iki šiol visame pasaulyje buvo aprašyta 15 įgimto enteropeptidazės nepakankamumo atvejų. Tačiau būklės simptomai yra daug dažnesni. Enteropeptidazės trūkumas ne visada turi būti. Kadangi tripsinas vaidina pagrindinį vaidmenį aktyvuojant virškinimo fermentus, tripsino trūkumas ar trūkumas taip pat sukelia panašius simptomus. Šių ligų gydymas abiem atvejais yra vienodas. Fermentai skiriami aktyvuota forma. Be abejo, yra dar daugiau nenustatytų enteropeptidazės trūkumo atvejų.
Jei diagnozė tikra, enteropeptidazė taip pat gali būti pakeista. Enteropeptidazės trūkumą antrą kartą sukelia ir sunkios žarnyno ligos.Ligos, tokios kaip celiakija, sutrumpėjęs plonoji žarna, laktazės trūkumas ar kitos, turėtų būti išaiškintos diferencinėje diagnozėje.