Vandenilio ryšys yra molekulių sąveika, panaši į Van der Waals sąveiką ir vykstanti žmogaus kūne. Ryšys vaidina svarbų vaidmenį peptidų jungtyse ir baltymų aminorūgščių grandinėse. Nesugebėdamas prisijungti prie vandenilio jungčių, organizmas nėra gyvybingas, nes jam trūksta gyvybiškai svarbių aminorūgščių.
Kas yra vandenilio jungtis?
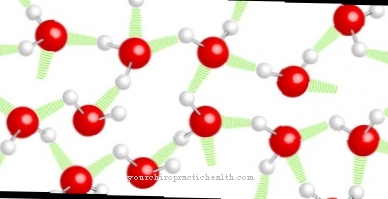
Vandenilio ryšiai yra vadinami Vandenilio jungtys arba H tiltai sutrumpintai. Tai yra cheminis poveikis, susijęs su patrauklia kovalentiškai surištų vandenilio atomų sąveika su laisvųjų elektronų, turinčių atomų grupę, poromis. Sąveika grindžiama poliškumu ir, tiksliau aprašyta, susideda tarp teigiamai poliarizuotų vandenilio atomų amino arba hidroksilo grupėje ir vienišų elektronų porų kitose funkcinėse grupėse.
Sąveika vyksta tik tam tikromis aplinkybėmis. Viena iš sąlygų yra laisvųjų elektronų porų elektroneigiama savybė. Ši savybė turi būti stipresnė nei vandenilio elektroneigiama savybė, kad būtų sukurtas stiprus ryšys. Taigi vandenilio atomas gali būti surištas poliariai. Elektronegatyviai laisvieji atomai gali būti, pavyzdžiui, azotas, deguonis ir fluoras.
Vandenilio ryšiai yra antriniai valentiniai ryšiai, kurių stipris paprastai yra daug mažesnis nei kovalentinių arba joninių jungčių. Vandenilio ryšiuose esančios molekulės turi palyginti aukštą lydymosi temperatūrą ir panašiai aukštą virimo temperatūrą jų molinės masės atžvilgiu. Ryšiai yra mediciniškai svarbūs pirmiausia dėl peptidų ir nukleorūgščių organizme.
Vandenilio ryšiai yra tarpmolekulinės jėgos. Be jų nebūtų, vanduo neegzistuotų įvairiose suvestinėse būsenose, bet būtų dujinis.
Funkcija ir užduotis
Vandenilio ryšys sąveikauja silpnai ir vyksta tarp dviejų dalelių arba molekulių viduje. Šiame kontekste jungties tipas vaidina svarbų vaidmenį, pavyzdžiui, formuojant tretines struktūras baltymuose. Biochemijoje baltymų struktūra reiškia skirtingus baltymo ar peptido struktūrinius lygius. Šių natūraliai atsirandančių medžiagų struktūros yra hierarchiškai suskirstytos į pirminę struktūrą, antrinę struktūrą, tretinę struktūrą ir ketvirtinę struktūrą.
Aminorūgščių seka yra pirminė struktūra. Kai baltymas yra minimas atsižvelgiant į jo erdvinį išsidėstymą, dažnai nurodomas baltymo pavidalas ir jo pokyčiai. Šiame kontekste konformacijos pokytis atitinka erdvinės struktūros pasikeitimą. Baltymų išdėstymas yra pagrįstas peptido ryšiu. Šis ryšys visada vienodai jungia aminorūgštis.
Ląstelėse peptidinius ryšius tarpininkauja ribosomos. Kiekvienas peptidinis ryšys atitinka vienos aminorūgšties karboksilo grupių ryšį su antrosios aminorūgšties aminorūgštimis, kurios yra susijusios su vandens pašalinimu. Šis procesas taip pat žinomas kaip hidrolizė.
Kiekviename peptidiniame ryšyje viena jungtis jungia C = O grupę su NH grupe. Azoto atomas turi lygiai vieną vienišą elektronų porą. Dėl didelio deguonies elektronegatyvumo ši laisvoji pora patiria O2 atomų elektronus atitraukiančią įtaką. Tokiu būdu deguonis iš dalies traukia vienišą elektronų porą į jungtį tarp azoto atomo ir anglies atomo, o peptidinis ryšys įgyja dalinį dvigubos jungties pobūdį. Dvigubos jungties pobūdis pašalina laisvą NH ir C = O grupių sukimąsi.
Peptidinių ryšių deguonies ir vandenilio atomai yra svarbūs formuojant visų peptidų ir baltymų struktūrą be išimties. Tokiu būdu dvi amino rūgštys gali prisijungti viena prie kitos. Po tokio prijungimo visi dviejų aminorūgščių grandinių peptidiniai ryšiai yra tiesiai priešais vienas kitą. Vandenilio atomai peptidiniame ryšyje yra santykinai teigiamai poliarizuoti, palyginti su deguonies atomais tiesiai priešinguose peptidiniuose ryšiuose. Tokiu būdu vandenilio ryšiai suformuoja ir sujungia dvi amino rūgščių grandines viena su kita.
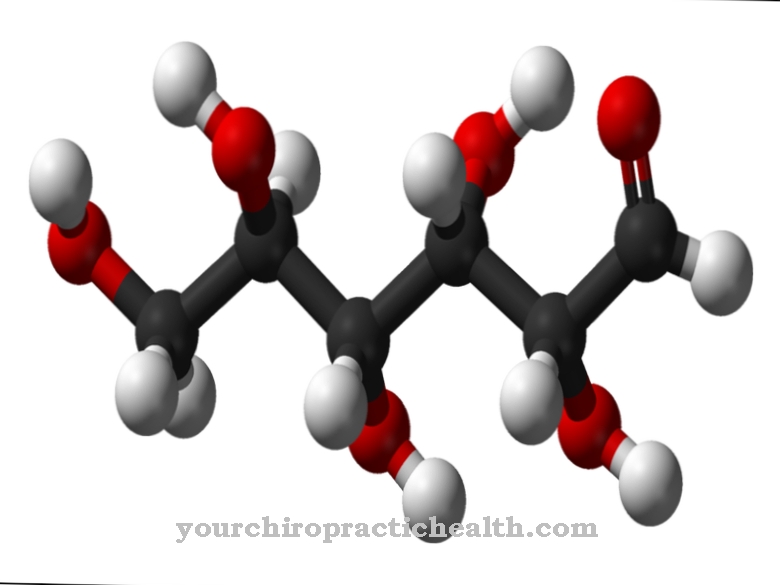
Visos žmogaus organizme esančios aminorūgštys yra organiniai junginiai, sudaryti iš bent vienos karboksigrupės ir vienos amino grupės. Amino rūgštys yra svarbus struktūrinis žmogaus gyvenimo komponentas. Be baltymų α-aminorūgščių, žinoma ir daugiau kaip 400 neproteinogeninių aminorūgščių, turinčių biologinių funkcijų, kurios negalėtų atsirasti be vandenilio jungimosi. Tokios jėgos kaip vandenilio ryšys stabilizuoja tretinę aminorūgščių struktūrą.
Savo vaistus galite rasti čia
➔ Vaistai nuo raumenų silpnumoLigos ir negalavimai
Jei yra funkcinių baltyminių erdvinių struktūrų formavimo sutrikimas, paprastai kalbama apie baltymų sulankstymo sutrikimus. Viena iš tokių sąlygų yra Huntingtono liga. Ši genetinė liga yra paveldima kaip dominuojantis autosominis bruožas ir atsiranda dėl genetinės mutacijos 4 chromosomoje. Mutacija lemia genų produkto nestabilumą. Liga yra neurologinė liga, pirmiausia susijusi su nevalinga distalinių galūnių ir veido hiperkineze. Nuolatinė hiperkinezė sukelia paveiktų raumenų standumą. Be to, šia liga sergantys pacientai patiria padidėjusį energijos suvartojimą.
Patologiniai simptomai, susiję su vandenilio jungtimis ar bendra baltymų struktūra, taip pat būdingi tokioms prionų ligoms kaip proto karvė. Populiariausia hipotezė yra, kad GSE skatina netinkamą baltymų išsiskyrimą. Šie netinkamai sulankstyti baltymai negali būti suskaidomi fiziologinių procesų metu, todėl kaupiasi audinyje, ypač centrinėje nervų sistemoje. Rezultatas - nervinių ląstelių degeneracija.
Baltymų struktūros apsigimimai taip pat aptariami dėl priežastinio Alzheimerio ligos ryšio. Minėtos ligos neturi tiesioginės įtakos vandenilio ryšiui, bet yra susijusios su baltymų erdvine struktūra, kuriai reikšmingas indėlis yra vandenilio jungtis.
Organizmas, visiškai negalintis prisijungti prie vandenilio, nėra gyvybingas. Tai sukelianti mutacija lemtų abortą ankstyvuoju nėštumo laikotarpiu.
















.jpg)


